ここでは脊椎動物の単一ニューロンの電気生理学的・形態学的データをもとに,そのニューロンのシミュレーションモデルとしてのマルチコンパートメントマルチコンパートメントモデルの作成,およびコンピュータシミュレーターへの実装までを解説していきます.
昆虫のニューロンの調べ方も参照のこと.
ニューロンのマルチコンパートメントモデルを作成するためには,そのニューロンの詳細な次元形態情報と樹状突起膜の電気生理学的性質をえる必要がある(図1). 次元形態情報を得るためには,通常ニューロンに蛍光色素を注入し,それを共焦点顕微鏡で光学的切片を作成し,それをコンピュータ上で再構成することにより行う(図2;2.実験データを基にしたマルチコンパートメントモデル作成参照).
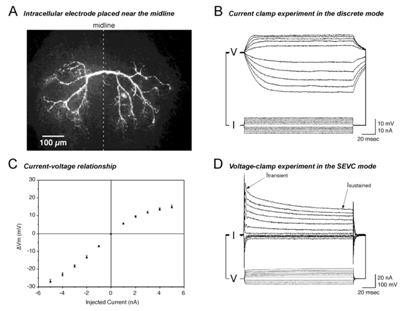
図1. ガラス管電極による細胞膜の電気的性質の計測 (From Takashima and Takahata, 2000)
次に樹状突起膜の電気生理学的性質を記録することになる.理想的には細胞の形態情報と電気生理学的性質は同じ一つのニューロンから取得することが望ましいが,蛍光色素をロードしたガラス管微小電極では,その整流作用や,電極抵抗の高さのため難しいことが多い.そこで昆虫の同定ニューロンという特徴をいかし,形態情報と電気生理学的性質を別標本の同定ニューロンから取得することを考えてもいい.
単一電極による不連続膜電位固定(つまりヴォルテージクランプ)をおこなうためにはどのような電極を用いるかは重要な問題である.理想的にはできる限り太い電極(すなわち低抵抗,かつ電極容量の小さいもので,整流作用を示さないものが望ましい.この点からガラス管として通常のボロシリケートのものよりも,石英のガラス管を用いる方が良いかもしれない.石英を用いれば多少抵抗が高くともヴォルテージクランプは可能である.ただし,石英ガラス管はレーザープラーで電極を作成しなけいればいけないかもしれない.
電極にロードする電解質は蛍光色素を用いるならばルシファーイエローの場合は1M LiClニューロビオチンを用いるのであれば2M KClである.脱分極で色素を注入しなければいけないが,電極抵抗の問題を考えるとニューロビオチンを用いる方がよいかもしれない.
実際の樹状突起膜の電気生理学的性質の計測は以下のような手順で行う.
1.1 ニューロンへの電極の刺入
1.2 静止膜電位の計測
1.3 過分極電流注入によるカレントクランプ.
これにより膜のpassiveな性質,膜の入力抵 抗,膜抵抗,膜時定数を求めることができる.過分極電流としては-1nAより小さい,昆虫の場合たとえば-0.2 nA程度でよいかもしれない.
1.4 ヴォルテージクランプ
静止電位から 10 mVステップで静止電位より30 mV程度過分極から0 mV程度まで行う200msec程度.
1.5 2ステップ ヴォルテージクランプ.
まず,2000 msec,10 mVステップでクランプして連続して0 mV程度までクランプする(階段状にクランプする).このことによりコンダクタンスの不活性化がどの程度の膜電位で起こるかが分かる.
1.6 2ステップ ヴォルテージクランプその2.
まず5 msecから20 msec程度0 mVまで脱分極し,連続して10 mVステップで静止電位よりプラスマイナス30mV程度まで数十msecヴォルテージクランプ.(図参照).このことによりコンダクタンスの平衡電位がわかる.
1.7 膜電流の薬理学的単離
以上のことが 無事終了したら,特定のコンダクタンス(チャネルと考えてよい)にたいする選択的ブロッカーを用いて薬理的に単離することをおこなう.ブロッカーを投与し(投与の仕方は場合によりけりだが還流投与かバスアプライでよい),完全にブロックしたい電流成分に消えるまで待つ.細胞が組織の中にある場合数十分かかるとみてよい.この状態で1.4.から1.6.と同様のことをおこなう. (図3)
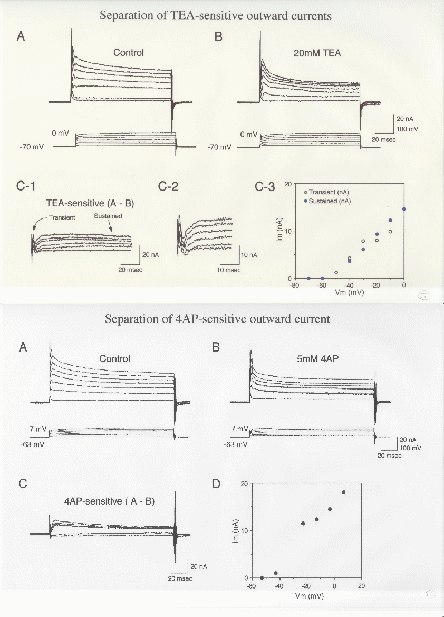
図2.ボルテージクランプとブロッカー還流投与によるコンダクタンスの単離(From Takashima and Takahata, 2000)
1.8
理想的にはこののち生理食塩水を還流して,膜電流が実験開始時まで戻るのを確認するのがよい.
1. 9
1.4.でえられた膜電流から7.で得られた膜電流を差し引くことで特定のブロッカーでブロックできる膜電流を単離する.5.でえられた膜電流から7.でえられた膜電流を差し引くことで特定の膜電流の不活性化の電位依存性がわかる.
1.10
1.5.でえられた膜電流から7.でえられた膜電流を差し引くことで特定の膜電流の不活性化の電位依存性がわかる.
1.11
1.6.でえられた膜電流から1.7でえられた膜電流を差し引くことで特定の膜電流の平衡電位がわかる. (図3)
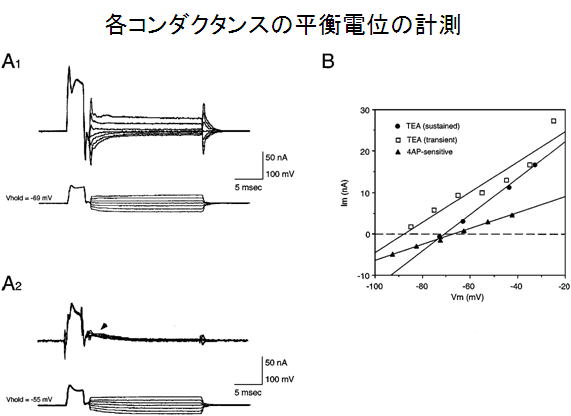
図3.各コンダクタンスの平衡電位の計測(From Takashima and Takahata, 2000
1.12
以上の実験結果をもとに,各パラメータを記述していく.
1.13 各H-H 方程式のパラメータの記述
以下,各パラメータの記述はThe Book of GENESIS 2nd p.29-4に詳しいのでそちらを参照してほしい.以下のホームページでその内容をすべて見ることができる.
http://www.genesis-sim.org/GENESIS/iBoG/iBoGpdf/chapt4.pdf
1.14 各パラメータの実験データとのフィッティング
1..13 で記述したパラメータを実験データをもとにフィッティングする.
1.15 以上で各コンダクタンスのによる記述はできたものとする.
2.実験データをもとにしたマルチコンパートメントモデルの作成
共焦点顕微鏡により得られた神経細胞の三次元スライス画像からマルチコンパートメントモデルを構成するには,三次元スライス画像からの神経細胞領域分離,樹状突起の中心線抽出,部分毎の円柱形状近似を行う必要がある.前二者(以下,構造抽出とよぶ)は後述の単一点距離変換を応用することで同時に行う事が可能である.また後者については,単一点距離変換により得られた結果から容易に行う事ができる.(詳細は追って更新していきます).
2.1ニューロンの構造抽出
構造抽出を行うに当たり,まず前処理として閾値を設定することにより三次元画像を二値化し,構造抽出の開始点座標を指定する(抽出開始点).その後,単一点距離変換により神経細胞の領域分離・中心線抽出を行う.アルゴリズムの概要は次の通りである.(実際にはより複雑な処理を行いより精度を高めているが,概ね下記の通りである.詳細については参考文献 A.Rodriguez et al., 2009 を参照されたし.)まず開始点に番号”0”を付与し,次に開始点に隣接する画素(以下,ヴォクセルとよぶ)に番号”1″を付与する.同様に番号”k”が付与されているヴォクセルに隣接する画素に番号”k+1″を付与する作業を隣接するヴォクセルが無くなるまで繰り返し実行する.最後に,互いに隣接し且つ同じ番号が付与されているヴォクセル同士をまとめ”クラスタ”を形成した後,各クラスタから代表座標をひとつず生成し,中心線を形成する点郡(中心点郡)を得る.
2.2マルチコンパートメントモデルの構成
上記の方法により得られた中心点郡および抽出された細胞領域を参考にしながら各中心点における樹状突起の半径を求める.その後,中心点と中心点を結ぶ線分を軸に持ち各中心点において求められた半径を持つ円柱(あるいは円錐台)で各部分を近似し,マルチコンパートメントモデルの形状とする.
3.マルチコンパートメントモデルへの各種イオンチャネルの組み込み(準備中)
ここでは汎用ニューロンシュミレータである,NEURON (Stanford Univ.)をもちいたマルチコンパートメントモデルへのイオンチャネルの組み込みを説明していく予定です.
Further reading
Nelson M and Rinzel J. The Hodgkin-Huxley model. In: The Book of GENESIS (2nd ed.), edited by Bower JM
and Beeman D. New Yoek: Springer-Verlag, 1997.
Alfredo Rodriguez, Douglas B. Ehlenberger, Patrick R. Hof, and Susan L. Wearne.
Three-dimensional neuron tracing by voxel scooping.
Journal of Neuroscience Methods. 2009; 184(1):169-175
Takashima A and Takahata M. Electrophysiological and theoretical analysis of depolarizing currents in the dendritic membrane of an identified nonspiking interneuron in crayfish. J Comp Neurosci 9:187-205, 2000